Amgens Portfolio an Modalitäten
Die Medizin hat sich in den letzten Jahrzehnten grundlegend verändert: Fortschritte in der Wissenschaft und die biotechnologische Revolution in den 1980er Jahren haben die Tür zu einer neuen Generation von Arzneimitteln geöffnet: den biotechnologisch hergestellten Wirkstoffen.
Im Gegensatz zu Arzneimitteln chemischen Ursprungs sind Biopharmazeutika Proteine und basieren auf den körpereigenen Grundlagen der menschlichen Biologie. Die Fortschritte in der Forschung und modernste Technologien ermöglichen inzwischen die Entwicklung komplexer Wirkstoffe, die individuell angepasst an die Mechanismen einer Erkrankung sind.
Bei Amgen nutzen wir das volle Potenzial des Protein-Engineerings und erforschen die menschliche Biologie, um die Entwicklung einer zunehmend personalisierten Medizin voranzutreiben.
Wir erforschen und produzieren sowohl biotechnologisch hergestellte Arzneimittel als auch small molecules.
Unsere Modalitäten
Antikörper-Wirkstoff-Konjugat
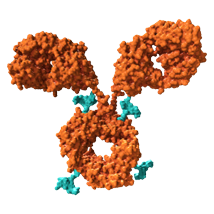
Antikörper-Wirkstoff-Konjugate zerstören effizient und zielgerichtet Krebszellen, ohne gleichzeitig dem gesunden Gewebe zu schaden. Dadurch, dass der therapeutische Wirkstoff an einen Antikörper geknüpft wird, lässt sich sehr genau steuern, in welchen Zellen des Körpers er wirken soll. Auf diese Weise können Schäden am gesunden Gewebe vermieden werden.
Bi-funktionale Moleküle der nächsten Generation
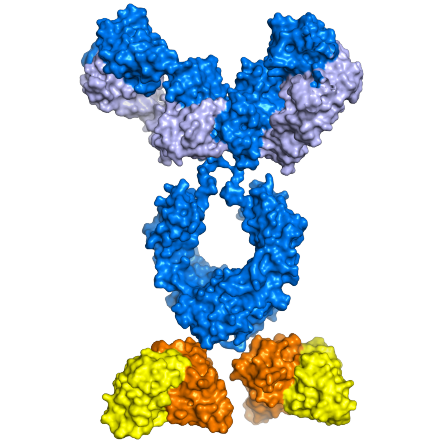
Bi-funktionale Moleküle bestehen aus zwei funktionellen Einheiten, die jeweils ein unterschiedliches Ziel im Körper ansteuern können. Wurden die Moleküle so verändert, dass sie eine höhere Wirksamkeit aufweisen und/oder besser an ihre Zielstrukturen im Körper binden, spricht man von einem Bi-funktionalen Molekül der nächsten Generation. Neben der Verbesserung der therapeutischen Wirkung können Nebenwirkungen verringert werden.
Bispezifische Antikörper
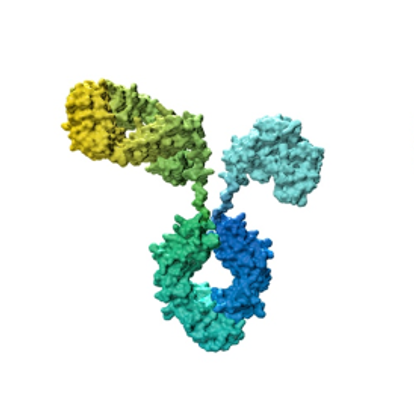
Bispezifische Antikörper werden genetisch aus zwei natürlich vorkommenden Antikörpern kombiniert. Sie werden bei der Behandlung komplexer Erkrankungen eingesetzt. Bispezifische Antikörper binden gleichzeitig an zwei unterschiedliche Zielstrukturen und bringen diese dadurch in Kontakt. Auf diese Weise können krankheitsfördernde Reaktionen unterbunden oder die Immunantwort verstärkt werden.
BiTE® Molekül und HLE BiTE® Molekül

Die BiTE® Technologie (Bispecific T-cell engager) ist ein Wirkansatz, der aktuell ausschließlich im Bereich der Krebstherapie Anwendung findet. Ein BiTE® Molekül ist ein künstlich hergestelltes Molekül mit zwei Bindungsarmen, das mit einem Arm an eine Krebszelle und mit dem anderen Arm an eine T-Zelle (eine Untergruppe der weißen Blutzellen) binden kann. Durch diese Bindung kann die T-Zelle zuvor unerkannte Krebszellen erkennen und zerstören. Aufgrund ihrer geringen Größe werden BiTE® Moleküle allerdings schnell ausgeschieden. Um dieser Herausforderung zu begegnen, hat Amgen die sogenannten HLE (Half Life Extended) BiTE® Moleküle entwickelt, die eine höhere Stabilität aufweisen und so eine längere Halbwertszeit im Körper bewirken. Das BiTE® Molekül wurde hierzu mit einem bestimmten Teil eines Antikörpers, Fc-Domäne genannt, verknüpft. Diese Modifikation verzögert den Abbau, sodass Patient:innen seltener behandelt werden müssen. Der Einsatz von BiTE® Molekülen auch außerhalb der Krebstherapie, speziell der Immunmodulation, wird aktuell erfrorscht.
Fusionsproteine
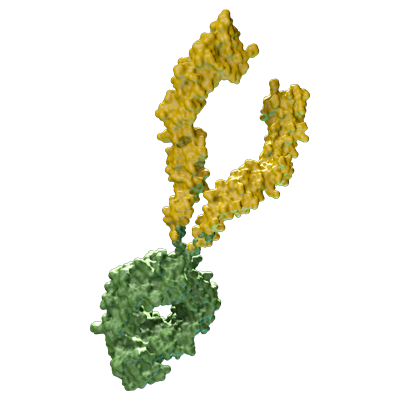
Fusionsproteine bestehen aus zwei oder mehr Proteinen und kombinieren damit deren Eigenschaften. Diese Kombination von Eigenschaften kann daraus bestehen, dass ein Teil gezielt an eine Rezeptorstruktur binden kann, um diese zu hemmen oder zu stimulieren, und der andere Teil den Abbau des Fusionsproteins verzögert und damit die Wirkung verlängert.
Kleine Moleküle

Kleine Moleküle, auch als small molecules bezeichnet, sind synthetisch hergestellte Moleküle und kleiner als Peptide und Proteine. Somit können sie einfacher in Zellen eindringen und sogar die Blut-Hirn-Schranke (Grenze zwischen Blut und Zentralnervensystem) passieren. Dadurch bieten sich vielfältige Einsatzmöglichkeiten für „small molecules“ zur Behandlung schwerer Erkrankungen.
Monoklonale Antikörper
Antikörper können spezifisch an Proteine binden, die an der Entstehung von Erkrankungen beteiligt sind. Sie kommen natürlicherweise im Körper vor und markieren Fremdkörper, z. B. Krankheitserreger, oder entartete Zellen, wodurch diese effizienter vom Immunsystem entfernt werden. Antikörper werden biotechnologisch hergestellt und für die Behandlung von Krankheiten, wie Krebs, Asthma oder chronisch-entzündlichen Erkrankungen, eingesetzt. Wird für die Herstellung der Antikörper im Labor nur eine einzige Zelllinie verwendet, spricht man von monoklonalen Antikörpern.
Peptide
Peptide sind kleine Proteine, die unter anderem als Hormone oder Signalmoleküle wirken und körpereigene Funktionen regulieren. Bildet eine Person ein bestimmtes Peptid nur in geringen Mengen oder gar nicht, kann die Injektion von therapeutischen Peptiden helfen, dieses Defizit auszugleichen. Die bekannteste Peptidtherapie ist die Anwendung von Insulin bei Diabetespatient:innen.
Peptibody
Peptide sind kleine Proteine, die natürlicherweise im Körper vorkommen. Werden sie Patient:innen zu therapeutischen Zwecken injiziert, können sie krankmachende Prozesse regulieren, jedoch baut der Körper sie meist schnell ab. Der Grund dafür ist die geringe Größe der Peptide. Verknüpft man sie mit einem Antikörperfragment entsteht ein Peptibody, der langsamer abgebaut wird. Dadurch müssen die Patient:innen das Arzneimittel seltener anwenden.
PROTAC

Nicht (mehr) benötigte Proteine werden in den Zellen abgebaut, um ihre Bausteine weiter zu nutzen, die Zellfunktion zu kontrollieren und fehlerhaften Proteinen vorzubeugen. Diesen Abbaumechanismus machen sich PROTAC-Moleküle (Proteolysis-Targeting Chimeras) zu nutze. Die Moleküle bestehen aus zwei funktionalen Einheiten. Eine Einheit bindet an das Zielprotein, nicht jedoch an andere Proteine der Zelle. Die zweite Einheit geht eine Verbindung mit der sogenannten Ubiquitin-Ligase ein. Diese gibt dem Proteasom der Zelle das Signal zum Abbau des Zielproteins, indem sie dieses mit einer Markierung, einem kleinen Ubiquitin-Molekül, versieht. Der Vorteil von PROTAC-Molekülen liegt darin, dass sie diese Markierung vermitteln, jedoch nicht dauerhaft gebunden sein müssen. So kann ein einzelnes PROTAC-Molekül den Abbau beliebig vieler Proteine auslösen.
siRNA/RNA-Interferenz
Zu therapeutischen Zwecken hergestellte siRNAs (small interfering RNAs) verhindern nach ihrer Injektion in den Körper die Entstehung bestimmter krankmachender Proteine. Sie nutzen das Prinzip der RNA-Interferenz, einen natürlichen Vorgang, bei dem die Zelle gezielt die Herstellung bestimmter Proteine stoppen kann. Dafür nutzt sie kleine RNA-Stücke, sogenannte siRNA, die genau zu einer bestimmten mRNA passen, dem Bauplan für ein bestimmtes Protein. Wenn siRNA an die mRNA bindet, wird der Bauplan zerstört und das krankmachende Protein kann nicht mehr gebildet werden.
Therapeutische Proteine
Therapeutische Proteine sind Wirkstoffe aus der Gruppe der Biopharmazeutika. Diese biotechnologisch erzeugten Proteine können natürliche Proteine ersetzen, die der Körper nicht selbst herstellen kann oder deren Funktion gestört ist. Sie greifen gezielt in biologische Prozesse ein, zum Beispiel durch ihre Wirkung als Enzyme, Antikörper oder Hormone. Darüber hinaus können therapeutische Proteine mittels gentechnischer Methoden modifiziert werden, um ihre Wirksamkeit zu erhöhen.
