Biomarker haben die Präzisionsmedizin bei Lungenkrebs deutlich vorangebracht. Vor der Ära der Präzisionsmedizin konnten nur zwei Arten von Lungenkrebs anhand ihrer Histologie unterschieden werden: nicht-kleinzelliger Lungenkrebs (NSCLC) und kleinzelliger Lungenkrebs (SCLC). Biomarker spezifizieren den Tumor weiter und sind ein wichtiges Puzzle-Stück für eine personalisierte Medizin.

Wird eine Person anhand der Stadt beschrieben, in der sie lebt, hat das nur wenig Aussagekraft. Merkmale wie die Größe, die Augenfarbe oder die Fingerabdrücke liefern konkretere Details zu einer Person und spezifizieren diese. In ähnlicher Weise funktionieren auch Biomarker in der Onkologie: Sie geben dem behandelnden Team die Möglichkeit, mehr Informationen über die Art des Lungenkrebses der oder des Betroffenen zu sammeln. Dies ist die Grundlage für eine personalisierte, zielgerichtete Therapie.
Biomarker in der Onkologie
Biomarker sind klinisch messbare Parameter, die Aufschlüsse über bestimmte biologische Prozesse geben und Hinweise auf eine Erkrankung liefern. Solche biologische Marker sind z.B. Zellen, Gene, Genprodukte oder bestimmte Moleküle wie Enzyme oder Hormone. Biomarker können mittels molekularer Diagnostik bestimmt werden, bei der eine kleine Menge Gewebe oder Blut entnommen und im Labor untersucht wird.
In der Onkologie können Biomarker z.B. genetische Mutationen der DNA umfassen, die eine Person für eine bestimmte Krebserkrankung prädisponieren können („prognostische Biomarker“). Ein bekanntes Beispiel hierfür ist die Mutation des BRCA-Gens im Zusammenhang mit Brustkrebs.
Mutationen können auch das Ansprechen auf eine bestimmte Therapie vorhersagen, dann handelt es sich um „prädiktive Biomarker“. (1)
Verbreitung von Lungenkrebs
Lungenkrebs gehört zu den häufigsten krebsbedingten Todesursachen in Deutschland und zu den prognostisch ungünstigsten Tumoren. (2, 3) Dank medizinischer Fortschritte und technischer Neuerungen konnte in den letzten Jahren mehr über die Krankheit in Erfahrung gebracht werden: Lungenkrebs lässt sich heute nicht nur in kleinzelligen oder nicht-kleinzelligen Lungenkrebs unterscheiden, es konnten auch immer mehr Biomarker identifiziert werden. EGFR, ALK, MET, ROS1, BRAF, RET, NTRK1, KRAS und HER2 – diese onkogenen Treibermutationen spezifizieren den Lungenkrebs zusätzlich und treten beim nicht-kleinzelligen Lungenkarzinom auf (4, 5).
KRAS-Mutationen beim nicht-kleinzelligen Lungenkrebs
Zu den am häufigsten mutierten Krebs-Genen bei Krebserkrankungen des Menschen zählt die RAS-Genfamilie, die seit fast vier Jahrzenten Gegenstand der Forschung ist. (6, 7) Das KRAS-Protein ist das am häufigsten veränderte „Familienmitglied“ bei soliden Tumoren.
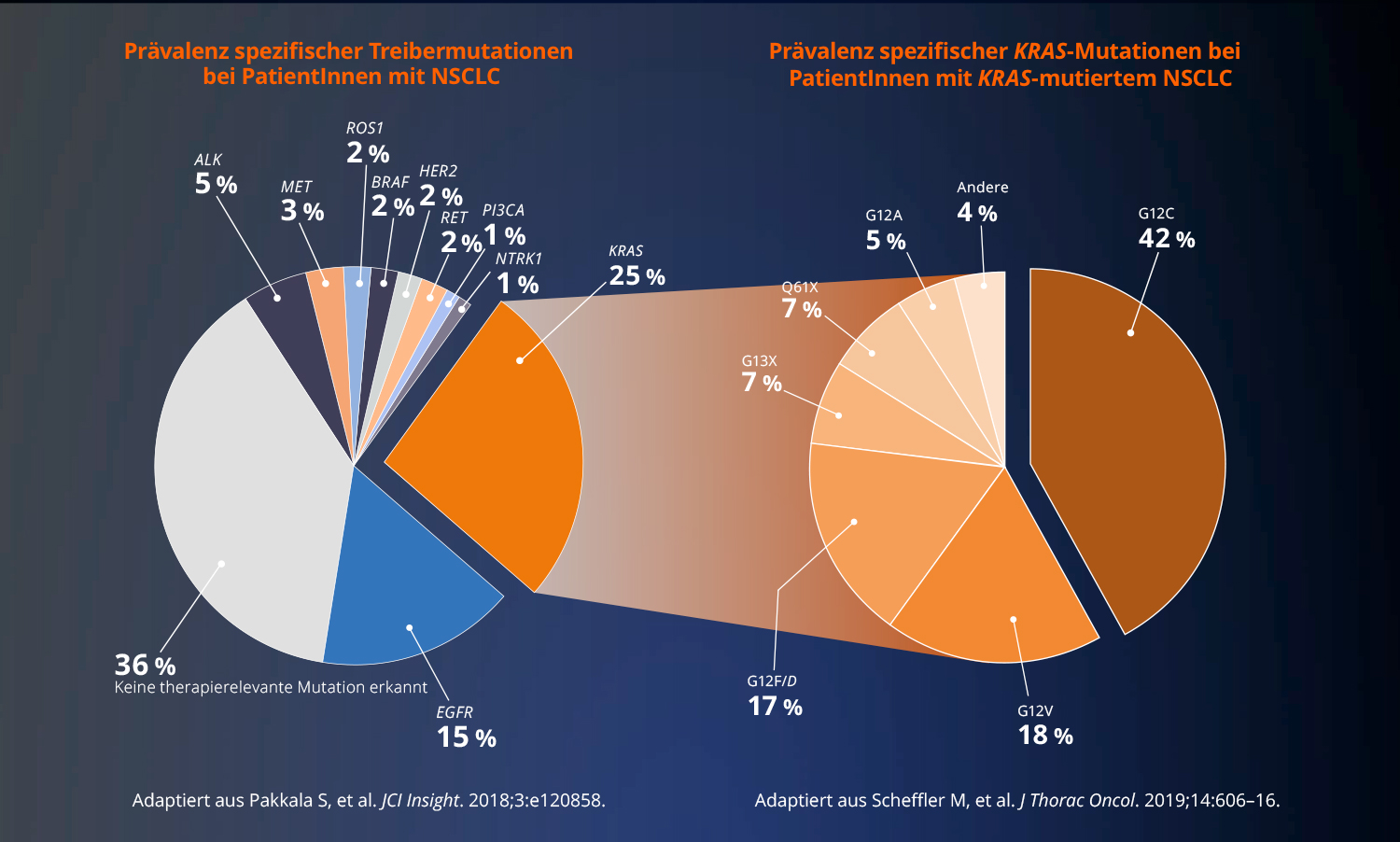
DNA-Aberrationen („Abweichungen“) des KRAS-Gens zählen zu den häufigsten onkogenen Treibern. Sie kommen bei ca. 25% der PatientInnen mit NSCLC vor. KRAS G12C, eine spezifische Form, wird bei etwa 11-13 Prozent der Patientinnen und Patienten mit NSCLC diagnostiziert. (4-6) Dabei handelt es sich um eine Punktmutation, d.h. um einen Mutation an einer einzelnen Base im KRAS Gen.
„Der durch die Mutation resultierende Austausch einer einzelnen Aminosäure im KRAS-Protein führt dazu, dass dieser Tumor eine spezifische molekulare Eigenschaft aufweist, die seit kurzem mit einer gezielten Therapie angreifbar ist“, sagt Dr. Achim Rieth, Ärztlicher Leiter der medizinischen Abteilung im Bereich Hämatologie/Onkologie bei der Amgen GmbH. „Die KRAS G12C-Mutation zeigt exemplarisch, wie wichtig es ist, die biologischen Prozesse und Mechanismen von Erkrankungen zu verstehen.“
Das KRAS-Protein ist schon seit mehr als 40 Jahrzenten Zielscheibe der medizinischen Forschung und galt bislang aber als „undruggable“. Unter anderem die äußerst glatte Oberfläche, mit Ausnahme einer Bindungsstelle, an die das Substrat GTP andockt, machte es Forscher:innen besonders schwer, Ansatzpunkte für molekulare Wirkstoffe zu finden. (6, 8) Mehr zu einem neuen Ansatz gegen diese Krebsmutation finden Sie hier.
Bedeutung von Biomarkern für zielgerichtete Therapien
„Wir lernen immer mehr über Tumore, nicht nur über ihre Gensequenzen, sondern auch darüber, wie sie „ticken“. Unser Verständnis dieser Biomarker gibt uns die Möglichkeit, Therapien mit molekularen Werkzeugen zu personalisieren, sodass immer mehr Betroffene die richtigen Behandlungen zur richtigen Zeit während ihres gesamten Krankheitsverlaufs erhalten,“ so Rieth.
In der Onkologie waren traditionell Kombinationen aus Operation, Chemotherapie, Strahlentherapie oder Immunonkologie die etablierten Pfeiler der Behandlung. Onkologen und Onkologinnen haben jetzt immer mehr Wissen und Werkzeuge, um bestimmte genetische Mutationen oder Biomarker in einigen Krebsarten zu identifizieren, die mit gezielten Therapien behandelt werden können.
Bei diesem Therapiekonzept wird die zugrunde liegende Genetik des Tumors entziffert und eine Therapie eingesetzt, die auf die zu behandelnde Person und ihr individuelles Mutationsprofil zugeschnitten wird. Eine ausgefeilte molekulargenetische Diagnostik ist ein wichtiger Teil des Puzzles, um Patientinnen und Patienten eine personalisierte Therapie zu ermöglichen. (Lesen Sie hier mehr zur Bedeutung von Biomarker-Tests). Darüber hinaus zeigen fortlaufende Biomarker-Tests in verschiedenen Stadien der Krebserkrankung den ÄrztInnen, wie sich der Krebs entwickelt, so dass sie den Behandlungsplan gegebenenfalls an die Veränderungen in der DNA des Tumors anpassen können. Die personalisierte Medizin kann daher schneller
- die richtige Behandlung für die richtige Patientin oder den richtigen Patienten finden,
- die Ergebnisse für Patientinnen und Patienten verbessern,
- unerwünschte Ereignisse minimieren oder sogar verhindern und
- dazu beitragen, die Effizienz des gesamten Gesundheitssystems zu verbessern.
Referenzen:
1. Califf RM. Biomarker definitions and their applications. Exp Biol Med (Maywood) 2018 Feb;243(3):213-21
2. https://www.onkopedia.com/de/onkopedia/guidelines/lungenkarzinom-nicht-kleinzellig-nsclc/@@guideline/html/index.html. Abgerufen am 21. Juni 2021.
3. https://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/kid_2019/kid_2019_c33_c34_lunge.pdf? Abgerufen am 21. Juni 2021.
4. Pakkala S et al. JCI Insight 2018; 3.
5. Scheffler M et al. J Thorac Oncol 2019; 14: 606-616.
6. Cox AD, et al. Nat Rev Drug Discov. 2014;13:828-851.
7. Fernandez-Medarde A, et al. Genes Cancer. 2011;2:344-358.
8. Ryan MB, Corcoran RB. Nat Rev Clin Oncol. 2018;15(11):709-720.
28.07.2021