Unser Immunsystem schützt uns vor Eindringlingen, Fremdkörpern und bösartigen Veränderungen. Eine Gruppe unserer Immunzellen, die T-Zellen, wirken dabei besonders effektiv gegen diese infizierten oder abnormalen Zellen. Deshalb stehen sie heute im Mittelpunkt zahlreicher Strategien, die es zum Ziel haben, Tumorerkrankungen mittels des körpereigenen Immunsystems gezielt zu bekämpfen. Auch die von Amgen in Deutschland entwickelte BiTE® (bispecific T cell engager)-Immunonkologie-Therapie beruht auf der Aktivität der T-Zellen gegen Krebs. Die bispezifischen Moleküle verknüpfen Krebs- mit T-Zellen und ermöglichen so die zielgerichtete Zerstörung des Tumors.
Unser Immunsystem: Die Funktion der T-Zellen
T-Zellen, auch T-Lymphozyten genannt, gehören zu den Leukozyten, unseren weißen Blutkörperchen. Als Bindeglied zwischen angeborener und erworbener Immunantwort ist es ihre Aufgabe, Fremdkörper und veränderte Körperzellen zu identifizieren und zu zerstören. Während die meisten Immunzellen diese fremden oder schädlichen Strukturen (Antigene) direkt erkennen können, benötigen die T-Zellen bei der Erkennung solcher Strukturen Unterstützung von anderen Zellen. Hierzu bringt die infizierte oder erkrankte Zelle ein Signalmolekül an ihre Oberfläche, das von T-Zellen erkannt wird. Die erkrankte Zelle nutzt dabei spezifische Proteine, die MHC-Rezeptoren. Die T-Zelle bindet das Antigen mit ihrem spezifischen T-Zellrezeptor. Dadurch wird sie aktiviert und leitet die Zerstörung der infizierten oder entarteten Zelle ein. Da jede einzelne T-Zelle nur einen spezifischen Antigen-Typ erkennen kann, muss das Immunsystem eine Variation verschiedener T-Zellen enthalten – doch wie ist diese Vielfalt möglich?1
Die Auslese der T-Zellen: Nur funktionstüchtige Kandidaten kommen zum Einsatz
Eine Vielzahl verschiedener T-Zellen mit jeweils einzigartigem T-Zellrezeptor wird von den Stammzellen im Knochenmark gebildet. Anschließend wandern die Zellen in den Thymus, eine Drüse des Lymphsystems, die der T-Zelle ihren Namen gibt. Dort werden zunächst jene T-Zellen selektiert, die die MHC-Rezeptoren binden können – denn ohne diese Fähigkeit würden erkrankte Zellen nicht zerstört werden können. In einer zweiten Runde werden alle diejenigen T-Zellen ausgeschlossen, die körpereigene Strukturen als schädlich einstufen. So können Autoimmunreaktionen, bei denen das Immunsystem normales Gewebe fälschlicherweise als Gefahr identifiziert, verhindert werden. Nur T-Zellen, die diese beiden Formen der Selektion überstehen, werden ins Blut abgegeben. Sie sind von nun an Teil des Immunsystems und entwickeln sich zu einer der zahlreichen Unterformen: T-Helferzelle, zytotoxische T-Zelle, regulatorische T-Zelle, T-Gedächtniszelle und andere.1
Zytotoxische T-Zellen: Die Waffe gegen Krebszellen
Für die zielgenaue Krebstherapie mittels BiTE®-Molekülen sind besonders die zytotoxischen T-Zellen von Bedeutung. Auf der Oberfläche dieser Zellen sitzt das Membranprotein CD8, welches spezifisch an MHC der Klasse I (MHC-I) bindet – also an jenes Protein, das für die Erkennung und Zerstörung kranker Zellen essentiell ist. MHC-I wird von allen Zellen des Körpers gebildet. Folglich können zytotoxische T-Zellen infizierte und entartete Zellen jeden Zelltyps erkennen und zerstören. Sie eignen sich daher bestens für den Einsatz gegen eine Reihe verschiedener Krebsarten.
Für die Zerstörung schütten die aktivierten zytotoxischen T-Zellen Botenstoffe, sogenannte Zytokine, und weitere Proteine aus: Freigesetzte Perforine durchlöchern die Membran der kranken Zelle. Durch die Öffnungen können wiederum andere Proteine, die ausgeschütteten Granzyme, in die Zelle eintreten. Sie aktivieren bestimmte Enzyme der Zielzelle, die Caspasen, wodurch diese stirbt. Dieser geordnete Zelltod wird auch als programmierter Zelltod oder Apoptose bezeichnet. Die Zytokine sorgen außerdem dafür, dass benachbarte Zellen mehr MHC-I-Proteine bilden. Dadurch werden infizierte oder entartete Zellen in der Folge besser von T-Zellen erkannt und eliminiert.1
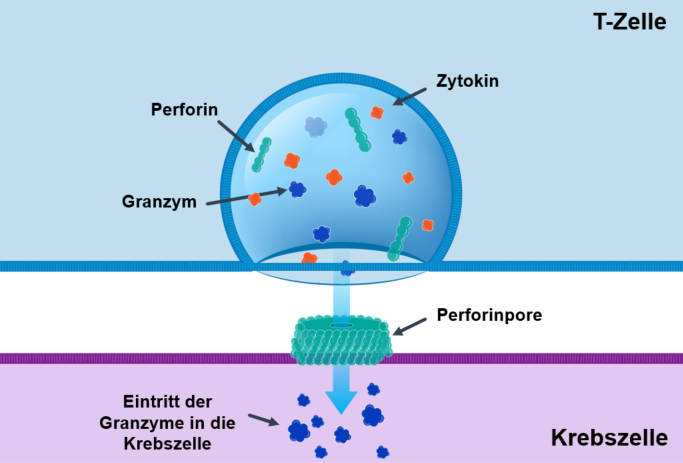
Elimination der Krebszelle durch die T-Zelle.
Herausforderungen bei der Identifizierung von Tumorzellen
Obwohl zytotoxische T-Zellen täglich entartete Zellen zerstören, entwickeln sich jedes Jahr bei über 450.000 Menschen in Deutschland bösartige Tumore.2 Der Grund dafür ist, dass Krebszellen unter dem Radar des Immunsystems bleiben können und so ihrer Eliminierung durch zytotoxische T-Zellen entgehen. Bei dem Prozess des sogenannten Immunoeditings können sich Krebszellen durch Selektion immer weiter anpassen und so auf lange Zeit überleben. Nach einer Zeitspanne von meist mehreren Jahren wird das unkontrollierte Tumorwachstum schließlich aktiviert und der Krebs breitet sich in rasantem Tempo im Körper aus.3, 4
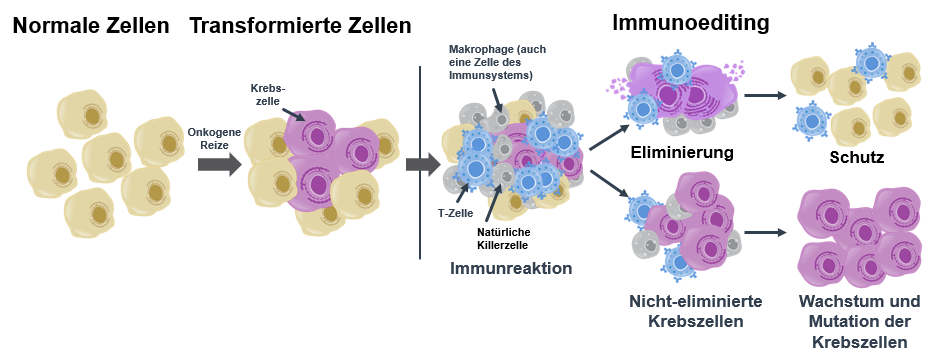
Der Prozess des sogenannten Immunoeditings: Im Optimalfall führt die Immunantwort unseres Körpers dazu, dass die Krebszellen eliminiert werden (oberer Pfad). Krebszellen, die sich der Eliminierung entziehen können, wachsen und mutieren, sodass ein bösartiger Tumor entstehen kann (unterer Pfad).
Krebszellen können beispielsweise die Antigenpräsentation, mit Hilfe derer die kranken Zellen auf sich aufmerksam machen, hemmen oder die Aktivierung und das Wachstum von zytotoxischen T-Zellen unterdrücken. Stattdessen locken sie dann eine andere Untergruppe der T-Zellen, die regulatorischen T-Zellen, an.5, 6, 7 Diese schützen unseren Körper vor Autoimmunreaktionen, identifizieren aber auch Tumorzellen als körpereigen und verhindern somit deren Zerstörung.1 All das trägt dazu bei, dass das Immunsystem den Tumor nicht erkennt und zerstört, wodurch dieser über Jahre überleben und sich ausbreiten kann.
Durch die BiTE®-Therapie lernt das Immunsystem, den Krebs wieder als schädlich einzustufen und zu eliminieren. Dieses neu erworbene Wissen wird möglicherweise auch an die nächste Generation der Immunzellen weitergegeben und die Wahrscheinlichkeit für den Tumorrückfall so reduziert.
Referenzen
1. Murphy, Ken, and Casey Weaver. Janeway's immunobiology. Garland Science, 2016.
2. Krebs in Deutschland 2013/2014, 11. Ausgabe, 2017, RKI
3. Kim, Ryungsa; Emi, Manabu; Tanabe, Kazuaki (2007). "Cancer immunoediting from immune surveillance to immune escape". Immunology
4. Reiman, Jennifer M., et al. "Tumor immunoediting and immunosculpting pathways to cancer progression." Seminars in cancer biology. Vol. 17. No. 4. Academic Press, 2007.
5. Beyer, Marc, and Joachim L. Schultze. "Regulatory T cells in cancer." Blood 108.3 (2006): 804-811.
6. Garrido, Federico; Romero, Irene; Aptsiauri, Natalia; Garcia-Lora, Angel M. (2016-01-15). "Generation of MHC class I diversity in primary tumors and selection of the malignant phenotype"
7. Syn, Nicholas; Wang, Lingzhi; Sethi, Gautam; Thiery, Jean-Paul; Goh, Boon-Cher (2016-07-01). "Exosome-Mediated Metastasis: From Epithelial-Mesenchymal Transition to Escape from Immunosurveillance". Trends in Pharmacological Sciences. 37 (7): 606–617.
01.12.2020