Unser Immunsystem schützt uns nicht nur vor Bakterien und Viren, sondern auch vor entarteten Körperzellen. Täglich entfernt unsere Abwehr diese Ausreißer, um die Entstehung von Krebsgeschwüren zu verhindern. Doch Krebszellen sind geschickt und lernen, der Beseitigung durch das Immunsystem zu entkommen. An diesem Punkt setzt die Immunonkologie an: mit Hilfe von entsprechenden Methoden und Wirkstoffen können Abwehrzellen Krebszellen erkennen und effektiv zerstören.
Die Krebstherapie befindet sich im Wandel
Operation, Bestrahlung, Chemotherapie - diese Methoden sind auch heute noch die am häufigsten angewendeten Vorgehensweisen im Kampf gegen Krebs. Vor allem Bestrahlung und Chemotherapie gehen jedoch mit zahlreichen Nebenwirkungen einher. Schließlich wirkt beides nicht nur gegen bösartige Krebszellen, sondern auch gegen das körpereigene gesunde Gewebe. Zielgerichteter zerstören zum Beispiel toxische und radioaktive Substanzen Krebszellen, wenn sie an Antikörper gekoppelt sind, die sich mit einer bestimmten Struktur auf der Oberfläche der Tumorzellen verbinden.1,2
Für diese sogenannten Targeted Therapies identifizieren Forscher Strukturen, die vor allem auf den Krebszellen vorkommen. Diese entstehen durch Mutationen im Genom der sich entwickelnden Krebszelle. Einerseits kann der Tumor so zielgerichtet zerstört werden, andererseits wird der Druck auf die Krebszellen erhöht, sich weiter anzupassen, um ihrer Zerstörung zu entgehen. Dies kann dazu führen, dass Krebszellen weiterhin unentdeckt bleiben. Anders ist dies bei den Methoden der Immunonkologie.3
Bedeutung und Entdeckung der Immunonkologie
Die Immunonkologie beschäftigt sich mit der therapeutischen Zerstörung von Krebszellen durch das körpereigene Immunsystem. Während zielgerichtete Krebstherapien direkt auf die Tumorzelle wirken, wird bei der Immunonkologie das Immunsystem des Patienten aktiviert, um den Krebs zu bekämpfen.4
Die Idee der Immunonkologie entstand durch Zufall. Als 1867 in Bonn der Tumor einer Patientin schrumpfte, nachdem sie in das Bett eines Wundrose-Patienten verlegt wurde, vermutete man bereits, dass das körpereigene Abwehrsystem den Krebs angreifen und beseitigen könne.5 Der Kontakt mit den Bakterien der Hautinfektion führte offenbar dazu, dass das Immunsystem der Patientin aktiviert wurde. Über 140 Jahre später war die Forschung auf dem Gebiet so weit vorangeschritten, dass die Immunonkologie vom Wissenschaftsmagazin „Science“ zum wissenschaftlichen Durchbruch des Jahres 2013 gekürt wurde.6
Das eigene Immunsystem mobilisieren
Die Therapieansätze der Immunonkologie können sich spezifisch gegen den Tumor richten oder ungerichtet wirken. Bei der unspezifischen Immuntherapie wird das Immunsystem allgemein aktiviert, um generell vermehrt gegen Fremdkörper, Krankheitserreger und entartete Zellen vorzugehen.7
Auch die Methode der Checkpoint-Inhibition gehört zur unspezifischen Immunonkologie. Dabei wird verhindert, dass sich Krebszellen als gesundes Gewebe tarnen und so ihrer Eliminierung entgehen. Hierzu werden spezifische Proteine auf der Oberfläche von T-Zellen, die Checkpoints, blockiert. Diese würden andernfalls an Tumorzellen binden und sie als ungefährlich einstufen. Allerdings dienen Immuncheckpoints generell der Erkennung körpereigener Strukturen. Folglich kann es bei der Blockierung der Checkpoints dazu kommen, dass das Immunsystem gesunde Zellen nicht mehr toleriert, sondern ebenfalls beseitigt, und damit autoimmune Nebenwirkungen auftreten.8
T-Zellen als effektive Waffe gegen Krebs
Im Gegensatz zur unspezifischen Immuntherapie richtet sich bei der Targeted Immunotherapy die gesteigerte Immunantwort gezielt gegen die Krebszellen. Dabei steht vor allem eine Gruppe der Abwehrzellen im Mittelpunkt: die T-Zellen.7
T-Zellen wirken stark zytotoxisch und können Krebszellen von Natur aus beseitigen. Durch Anpassungen schaffen es die Tumorzellen allerdings, ihrer Erkennung durch die T-Zellen zu entkommen. Therapieansätze der Immunonkologie zielen deshalb darauf ab, dass T-Zellen Krebszellen identifizieren können und als Gefahr für den Organismus einstufen.
Eine vielversprechende Methode ist die CAR-T-Zell-Therapie (engl. Chimeric Antigen Receptor), bei der dem Patienten zunächst eigene T-Zellen entnommen werden. Außerhalb des Körpers werden sie gentechnisch modifiziert, um Krebszellen effizienter erkennen und zerstören zu können. Im Anschluss werden sie dem Patienten wieder zugeführt (adaptiver T-Zelltransfer).9 CAR-T-Zellen bleiben lange im Körper aktiv und müssen deshalb selektiv gegen entartete Zellen wirken, ohne gesundes Gewebe zu zerstören. Die Therapie zählt zur personalisierten Medizin und muss an jeden Patienten individuell angepasst werden.10
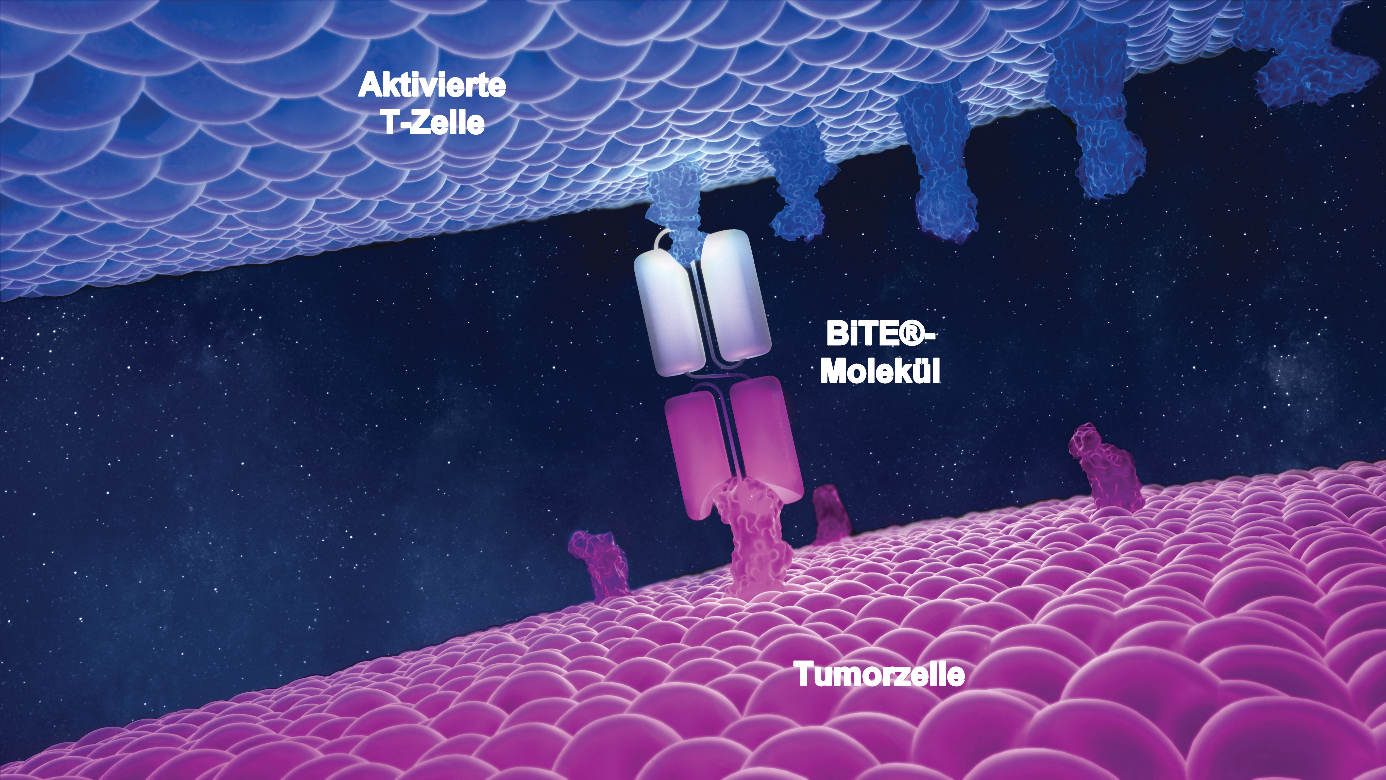
Ein weiterer innovativer Ansatz in diesem Bereich ist die BiTE®-Technologie. Anders als bei der CAR-T-Zell-Therapie handelt es sich hierbei um eine universelle Plattform, die bei der Behandlung von verschiedenen Krebsarten zum Einsatz kommen kann. Die biotechnologisch hergestellten bispezifischen Moleküle binden gleichzeitig an eine Krebszelle und eine T-Zelle. Sie dienen als Brücke zwischen den Zellen und ermöglichen so den direkten Angriff der T-Zelle auf die Tumorzelle.10, 11
Viren können Tumorzellen zerstören
Heute machen sich Forscher bei der Bekämpfung von Krebs nicht nur die Eigenschaften des Immunsystems, sondern auch die von Viren zu Nutze. Denn es liegt in der Natur von Viren, Zellen zu befallen und sich in ihnen zu vermehren. Im Labor können Viren gentechnisch so verändert werden, dass sie nur Krebszellen und keine gesunden Zellen infizieren. Diese sogenannten onkolytischen Viren können zudem die biologischen Prozesse der Krebszellen manipulieren und die Produktion bestimmter Signalmoleküle und tumorspezifischer Strukturen, der Antigene, anregen.12, 13
Nach der Infektion vervielfachen sich die onkolytischen Viren in den Tumorzellen, bis diese schließlich platzen. Die Viren werden freigelassen und können neue Krebszellen infizieren. Zudem werden Immunzellen durch Signalmoleküle angelockt. Sie sollen die tumorspezifischen Antigene erkennen und Krebszellen an anderer Stelle im Körper angreifen, die dasselbe Antigen tragen.13
Kombination verschiedener Therapieoptionen
Die Methoden der Immunonkologie gewinnen mehr und mehr an Bedeutung. In dem Maße wie ihre Vielfalt wächst, nehmen auch die Möglichkeiten zu, verschiedene immunonkologische Ansätze miteinander zu kombinieren, um Krebserkrankungen aus verschiedenen Richtungen zu bekämpfen.
So könnte in Zukunft beispielsweise die BiTE®-Technologie mit der Checkpoint-Inhibition verknüpft werden. Denn während bispezifische Moleküle die T-Zellen zum Tumor locken, erschweren Checkpoint-Inhibitoren den Plan der Krebszellen, ihre Erkennung durch neu eingetroffene T-Zellen zu unterdrücken. Auch könnten onkolytische Viren Entzündungsreaktionen im Tumorgewebe verstärken und so den Effekt der Checkpoint-Inhibitoren unterstützen.
Referenzen
1. Akbari, Bahman, et al. "Immunotoxins in cancer therapy: Review and update." International reviews of immunology 36.4 (2017): 207-219.
2. Scott, Andrew M., Jedd D. Wolchok, and Lloyd J. Old. "Antibody therapy of cancer." Nature reviews cancer 12.4 (2012): 278-287.
3. Shekarian, Tala, et al. "Paradigm shift in oncology: targeting the immune system rather than cancer cells." Mutagenesis 30.2 (2015): 205-211.
4. Hughes, Paul E., Sean Caenepeel, and Lawren C. Wu. "Targeted therapy and checkpoint immunotherapy combinations for the treatment of cancer." Trends in immunology 37.7 (2016): 462-476.
5. Busch, W. "Aus der Sitzung der medicinischen Section vom 13 November 1867." Berl Klin Wochenschr 5 (1868): 137.
6. Couzin-Frankel, J. “Cancer Immunotherapy” Science (2013)
7. Monjazeb, Arta M., et al. "The role of antigen-specific and non-specific immunotherapy in the treatment of cancer." Journal of immunotoxicology 9.3 (2012): 248-258.
8. Thallinger, Christiane, et al. "Review of cancer treatment with immune checkpoint inhibitors." Wiener Klinische Wochenschrift 130.3-4 (2018): 85-91.
9. Wang, Xiaoping, et al. "Humanized anti-EGFR antibody panitumumab inhibits tumor growth of inflammatory breast cancer by inducing antitumor immunity." (2019): 4492-4492.
10. Choi, Bryan D., et al. "Bispecific antibodies engage T cells for antitumor immunotherapy." Expert opinion on biological therapy 11.7 (2011): 843-853.
11. Gregory, Richard C., et al. "The anti-TGFβ neutralizing antibody, SAR439459, blocks the immunosuppressive effects of TGFβ and inhibits the growth of syngeneic tumors in combination with anti-PD1." (2018): 2790-2790.
12. Gujar, Shashi A., and Patrick WK Lee. "Oncolytic virus-mediated reversal of impaired tumor antigen presentation." Frontiers in oncology 4 (2014): 77.
13. Lawler, Sean E., et al. "Oncolytic viruses in cancer treatment: a review." JAMA oncology 3.6 (2017): 841-849.
10.11.2020