In der medizinischen Forschung und Entwicklung werden große Mengen an Daten herangezogen mit dem Ziel, möglichst schnell zielgerichtete Therapien für Patient:innen zu entwickeln – aber wie genau können diese Daten helfen? Die Untersuchung der Variation in der DNA-Sequenz von Genen kann der Ausgangspunkt für ein tiefergreifendes Verständnis unserer Biologie sein. Dadurch können Ursachen von Krankheiten nicht nur besser verstanden werden; es ergeben sich daraus unter Umständen auch neue Möglichkeiten zur Diagnose, Behandlung und Prävention. Die Analyse von gesundheitsrelevanten Daten hat das Potential, die Forschung und Entwicklung von Arzneimitteln zu revolutionieren – das zeigt die Arbeit des Unternehmens deCODE Genetics, das seit 2012 zu Amgen gehört.

Trotz des stetigen Fortschritts der modernen Medizin ist unser Verständnis über unsere Biologie noch begrenzt. Klar ist, dass Entstehung und Verlauf von Krankheiten von zahlreichen Faktoren abhängen, die von Mensch zu Mensch unterschiedlich sind. Um ein genaues Bild über diese Zusammenhänge zu erhalten, werden verschiedene Forschungsansätze kombiniert, die darauf abzielen, die biologischen Mechanismen der Krankheitsentstehung besser zu verstehen.(1) Insbesondere molekularbiologische Methoden aus der „omik-“Forschung werden dafür herangezogen:
- Mithilfe der Genomik wird der Aufbau von Genomen und die Wechselwirkungen zwischen Genen untersucht. Gene geben den Zellen Anweisungen für die Herstellung von bestimmten Proteinen, die dann eine bestimmte Funktion im Körper ausüben. Die Vorlage für diese Proteine liefert die RNA, in die unsere Gene umgeschrieben werden.
- Die Transkriptomik zeigt, welche Gene exprimiert werden, also in Erscheinung treten, und welche stumm bleiben.
- Die Proteomik liefert dann eine detaillierte Bestandsaufnahme der im Blut oder Gewebe vorhandenen Proteine.
Die Kombination von Genomik, Proteomik und Gesundheitsdaten hat das Potential, neue Biomarker für eine frühere Krankheitsdiagnose, schnellere und erfolgreichere klinische Studien und die Vorhersage und Vorbeugung von Krankheiten zu liefern, bevor diese schwerwiegend und kostspielig werden. Diese „Big Data“-Methode, die Daten aus verschiedenen Quellen miteinander verknüpft, ist hierbei essenziell. So sind nach Auswertung möglichst großer Datensätze bereits heute in einigen Fällen Vorhersagen über Krankheitsverläufe möglich. Die Erkenntnis, welche Proteine bei welchen Krankheiten eine Rolle spielen, ist Grundlage für weiterführende Forschung und die erfolgreiche Entwicklung einer zielgerichteten Therapie. In der Arzneimittelentwicklung können so die Erfolgschancen eines Medikaments von 10 auf 20 Prozent erhöht werden.(2)

Variationen in der DNA wirken sich auf das Krankheitsrisiko beim Menschen aus
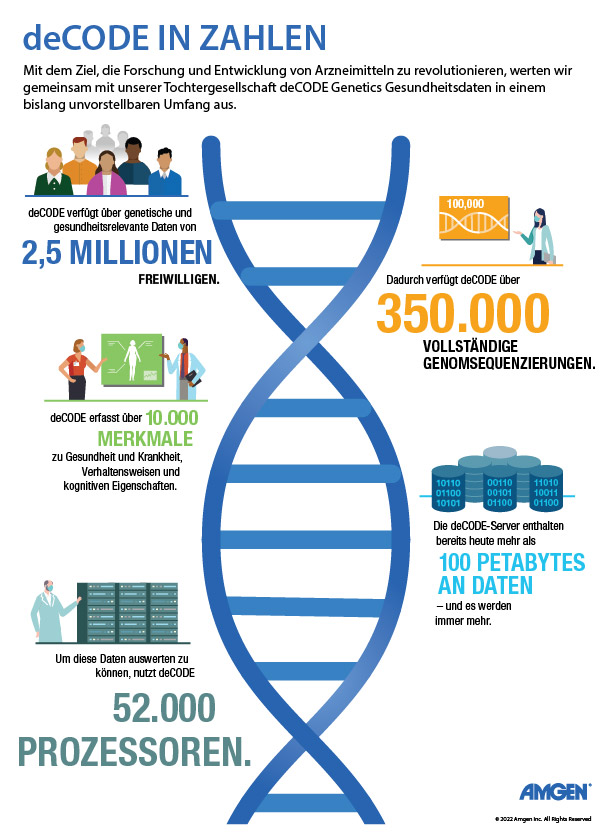
Das in Island ansässige Unternehmen deCODE Genetics, das seit 2012 Teil von Amgen ist, gehört zu den Vorreitern der Genforschung. Mittlerweile verfügt es über zwei umfangreiche Datensätze mit genetischen und gesundheitsrelevanten klinischen Informationen von der Hälfte der Isländer:innen. Es leistete Pionierarbeit bei der Anwendung statistischer Methoden, um signifikante Verbindungen zwischen diesen beiden Datensätzen zu finden. Der eine Datensatz enthält genetische Daten, die von der Bevölkerung Islands zur Verfügung gestellt wurden. Der andere Datensatz stammt aus dem isländischen Gesundheitssystem und enthält phänotypische Informationen zu Krankheiten und anderen körperlichen Merkmalen. Bei der Suche nach nicht zufälligen Assoziationen konnte deCODE bereits mehrere genetische Varianten finden, die mit einem erhöhten Krankheitsrisiko einhergehen. Das ermöglichte wichtige Einblicke in die Pathogenese, also Entstehung, Entwicklung, Risiko und Verlauf von erblich bedingten Krankheiten. Ähnliche oder gleiche Symptome bei Patient:innen scheinen zwar auf den ersten Blick dieselbe Krankheit zu sein, können aber unterschiedliche Ursachen haben und somit unterschiedliche Therapien benötigen. Die Auswertung gesundheitsbezogener Datensätze kann in diesen Fällen zu einer sicheren Diagnose und zielgerichteten Behandlung beitragen.
Um noch mehr seltene Varianten in einer Genomsequenz zu erfassen, die das Krankheitsrisiko beeinflussen, hat deCODE seine Forschung in den letzten Jahren auch über Island hinaus ausgeweitet. „Die Hauptaufgabe der Humangenetik ist die Untersuchung der menschlichen Vielfalt und die Vielfalt in Island ist etwas begrenzt, weil wir eine kleine und relativ homogene Bevölkerung sind“, sagt Gründer Kári Stefánsson. Mittlerweile tragen Daten von Millionen Menschen aus der ganzen Welt zu dieser Forschung bei, darunter auch die 500.000 Teilnehmer:innen der britischen Biobank. Die gemeinnützige Forschungseinrichtung verfolgt den Gesundheitszustand von älteren Freiwilligen, um die Diagnose, Behandlung und Prävention von Krankheiten zu verbessern. Seit 2019 arbeitet deCODE gemeinsam mit dem Wellcome Sanger Institute in Großbritannien am Whole Genome Sequencing Project – dem bisher größten Projekt dieser Art. Es zielt darauf ab, die vollständigen Genome aller Biobank-Teilnehmer:innen zu entschlüsseln.
Bedeutung der Genforschung für klinische Studien
Fast alle erblich bedingten Krankheiten entstehen durch Defekte in einem oder mehreren Genen, aber erst durch das Zusammenspiel von genetischen und Umweltfaktoren werden sie exprimiert. Um entsprechende Arzneimittel und Therapien zu entwickeln, muss das Zusammenspiel solcher multifaktoriellen Merkmale besser verstanden werden. Hier zeichnet sich dank der Fortschritte in der Humangenetik ein Wandel ab. Nach der erstmaligen Entzifferung des menschlichen Genoms vor rund 20 Jahren gibt es nun Bestrebungen, die Gesamtheit der DNA-Modifizierungen, das Transkriptom und das Proteom des Menschen, zu entschlüsseln. Die Ausweitung der „omik“-Forschung kann zukünftig auch Einfluss auf die Suche nach neuen Ansatzpunkten in der Arzneimittelforschung haben und die Art und Weise, wie klinische Studien konzipiert und interpretiert werden, erheblich verändern.
Bislang stellen klinische Studien den größten Kostenfaktor in der Forschung und Entwicklung neuer Arzneimittel dar, da sich vielversprechende Ansätze oft nicht wie gedacht entwickeln. Die Datenanalyse allein kann und soll diese aufwändige und langwierige Arbeit nicht ersetzen, unterstützt sie jedoch. Große Datensammlungen, wie die von deCODE, können zu genaueren und aussagekräftigeren Ergebnissen zahlreicher Studien beitragen. Die Genforschung kann so die Erfolgschancen für Arzneimittel in klinischen Studien enorm erhöhen, etwa durch eine genetische Validierung eines neuen Therapieziels (die Feststellung, inwieweit sich die Manipulation an einem Target vorteilhaft auswirkt oder nicht) vor Beginn der aufwändigen klinischen Prüfung oder mit der Erstellung von genetischen Risikoscores. Anhand derer können Patient:innen ermittelt werden, die am ehesten von neuen Forschungstherapien profitieren und diese benötigen. In einer Studie, die deCODE gemeinsam mit der Universität Island und dem nationalen Universitätsklinikum Islands durchgeführt hat, wurde der Ansatz zur Ermittlung von Risikoscores in der Praxis angewandt: Um die Rolle einzelner Proteine in Zusammenhang mit verschiedenen Krankheiten zu untersuchen, wurden etwa 5.000 verschiedene Proteine im Plasma von knapp 23.000 Isländer:innen gemessen, deren Genome bereits sequenziert worden waren. Aus den Erkenntnissen dieser Analyse entwickelten die Forschenden eine Vorhersagevariable (sog. Prädiktor), mithilfe derer Personen mit einem besonders hohen Herzinfarktrisiko identifiziert werden können.(3)
„Diese Risikoscores können in Zukunft den Umfang, die Dauer und die Kosten von klinischen Studien senken. So wird auf Basis dieser Scores zum Beispiel sichergestellt, dass Patient:innen mit sehr unterschiedlichen Risikotypen oder -graden nicht in derselben Studie untersucht werden. Außerdem ist die Identifizierung von Hochrisikopatient:innen möglich, die dann explizit in Studien inkludiert werden und dadurch eine sofortige Behandlung erhalten. Langfristig ist dies ein weiterer Schritt in Richtung personalisierter Medizin - die richtige Therapie in der richtigen Dosis für die richtigen Patient:innen zum richtigen Zeitpunkt“, erklärt Dr. Stefan Kropff, Medizinischer Direktor der Amgen GmbH.
Nutzen über Erforschung von Krankheiten hinaus
Die gesammelten Daten tragen nicht nur zu einer zielgerichteteren medizinischen Forschung und verbesserten Studiendesigns bei. deCODE nutzt seine großen Datensätze auch, um die genetische Grundlagenforschung voranzutreiben. Untersucht wird etwa die Rolle von Neandertaler-DNA in modernen Genomen oder das Zusammenspiel von genetischen und Umweltfaktoren in multifaktoriellen Merkmalen. Auch in der Ahnenforschung finden die Daten Anwendung. 2018 gelang es, das Genom eines ehemaligen Sklaven zu rekonstruieren, der 1802 nach Island ausgewandert war, heiratete und zwei Kinder bekam. deCODE gelang die Genotypisierung von 182 seiner 788 Nachkommen sowie die Genomsequenzierung von 20 dieser Nachfahren. Mithilfe dieser Informationen konnten Teile seines mütterlichen Genoms rekonstruiert und daraus ihre Herkunft abgeleitet werden.(4) Diese Beispiele stellen nur einen Teil der Anwendungsmöglichkeiten der Humangenetik dar, der über die medizinische Forschung hinausgeht. Mit der Weiterentwicklung technischer Möglichkeiten zur Datenanalyse können wir also nicht nur das Wissen über unsere Biologie, sondern auch das Verständnis über unsere Herkunft erweitern.
Referenzen
1. Erdmann, Pia, et.al., Medizinische Versorgung: Systemmedizin – Herausforderungen eines aktuellen Ansatzes, Deutsches Ärzteblatt (2015): 112(31-32). https://www.aerzteblatt.de/archiv/171430/Medizinische-Versorgung-Systemmedizin-Herausforderungen-eines-aktuellen-Ansatzes.
2. Nelson, Matthew R., et al. "The support of human genetic evidence for approved drug indications." Nature genetics 47.8 (2015): 856.
3. Eiriksdottir, T., Ardal, S., Jonsson, B.A. et al. Predicting the probability of death using proteomics. Commun Biol 4, 758 (2021). https://doi.org/10.1038/s42003-021-02289-6.
4. Jagadeesan, A., Gunnarsdóttir, E.D., Ebenesersdóttir, S.S. et al. Reconstructing an African haploid genome from the 18th century. Nat Genet 50, 199–205 (2018). https://doi.org/10.1038/s41588-017-0031-6.



