Wir bei Amgen haben es uns zur Aufgabe gemacht, innovative Arzneimittel für schwerwiegende und bislang unheilbare Erkrankungen zu entwickeln. In den über 40 Jahren, in denen wir bereits in der Arzneimittelforschung tätig sind, hat sich auf diesem Gebiet viel getan: Unser Verständnis der Mechanismen im Körper ist gewachsen, wodurch wir heute viele Erkrankungen schon sehr gezielt behandeln können – aber immer noch längst nicht alle. In der neuen Ära der Arzneimittelentwicklung, in der sogenannte multispezifische Moleküle in den Fokus rücken, könnte sich das ändern.
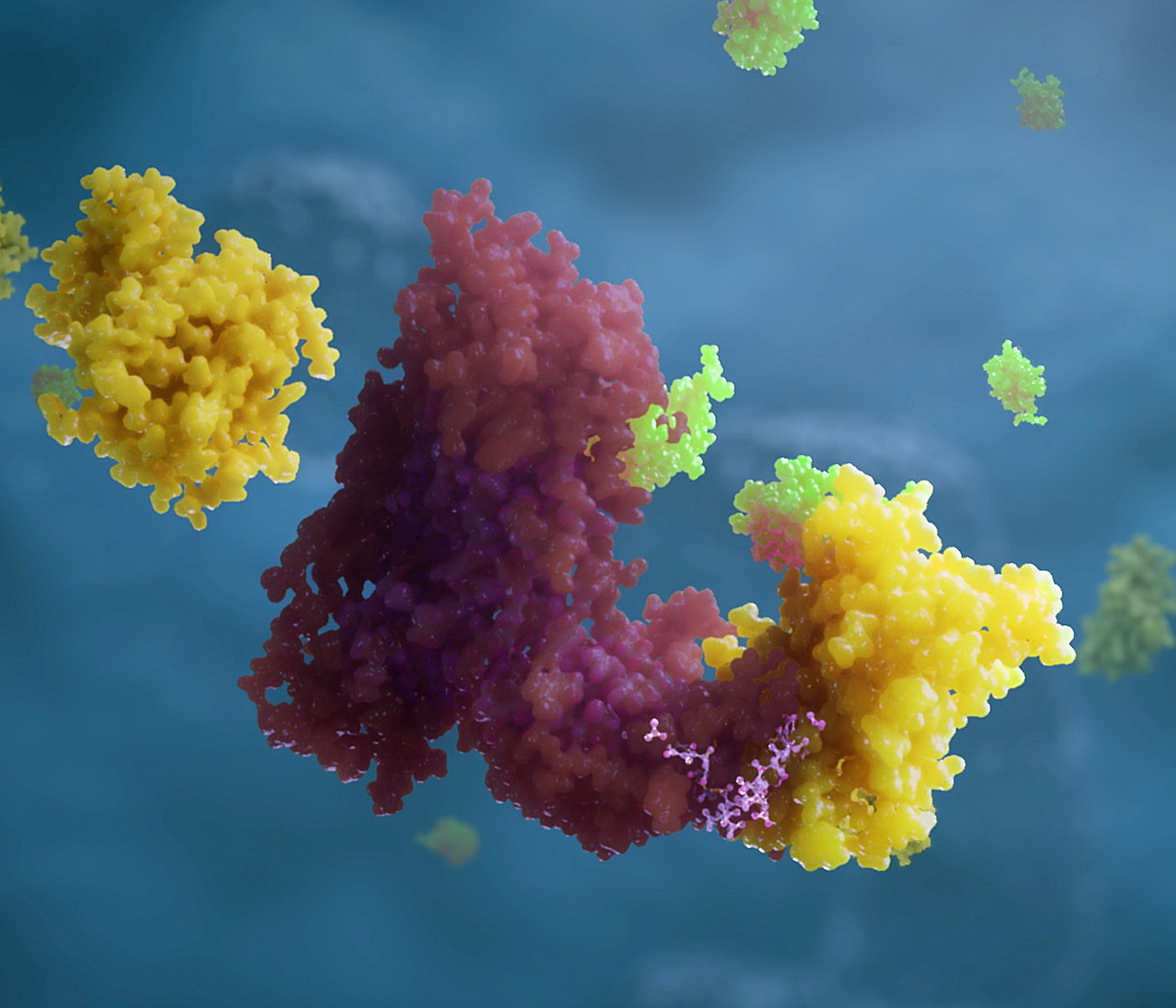
Ein PROTAC® (kleines pinkes Molekül in der Mitte) bringt das Zielprotein (gelb) in räumliche Nähe zum Enzym Ubiquitin-Ligase (rot), welches das Protein Ubiquitin (grün) an das Zielprotein bindet und so für den Abbau durch die Zelle markiert.
Wir gehen zunächst ungefähr ein Jahrhundert in der Geschichte zurück:
- Die Entwicklung von Aspirin Anfang des 20. Jahrhunderts war die erste wegweisende Errungenschaft in der Arzneiforschung. Aus ihr resultierte die erste Welle der Arzneimittelentwicklung, in der chemisch synthetisierte Medikamente auf den Markt kamen, deren Biologie weitgehend unbekannt war. Sie wirkten, aber man wusste nicht genau warum.
- In den 1970er Jahren führte die zweite Welle der Arzneimittelentwicklung das Schlüssel-Schloss-Prinzip ein: Dabei dockt das Wirkstoff-Molekül an dasjenige Molekül, das die Erkrankung auslöst, und verändert dessen Aktivität. Die biologischen Mechanismen von Erkrankungen waren schon besser bekannt, weshalb die Wirkung eines Arzneimittels darauf abgezielt werden konnte.
- Die dritte Welle der Arzneimittelentwicklung, die biotechnologische Revolution, wurde in den 1980er Jahren eingeläutet. Die Technologie der rekombinanten DNA (künstliches DNA-Molekül, das mittels gentechnischer Methoden verändert werden kann) ermöglichte es, über chemisch synthetisierte Wirkstoffe hinaus zu gehen und Arzneimittel auf der Grundlage von Proteinen und anderen großen Molekülen zu entwickeln.
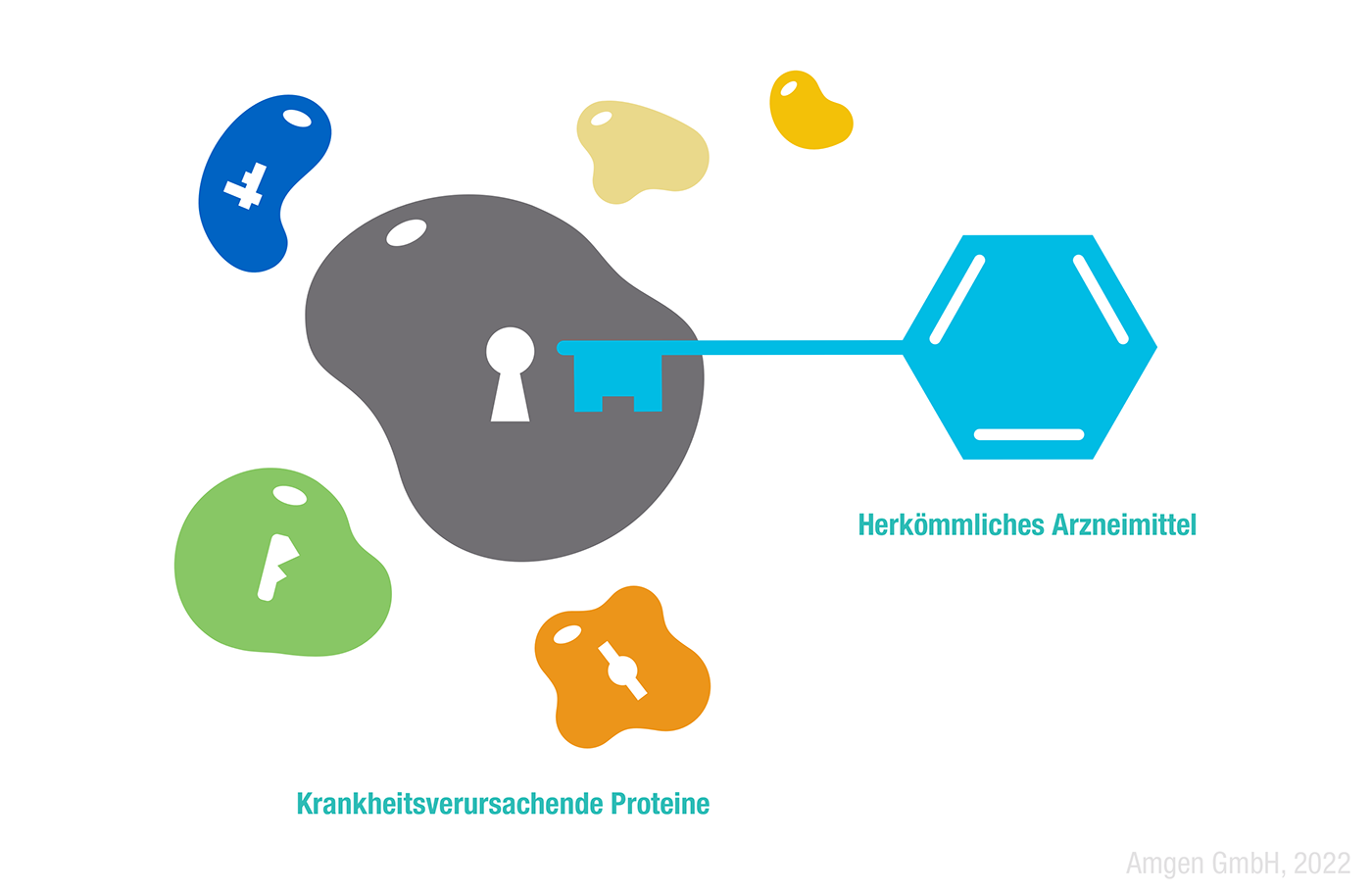
Diese Innovationen waren zwar in vielerlei Hinsicht bahnbrechend, änderten aber nicht die grundsätzliche Vorstellung von der Funktionsweise von Arzneimitteln. Fast alle Medikamente, die seit Aspirin zugelassen wurden, funktionieren nach demselben Prinzip: Ein Molekül, der Wirkstoff des Arzneimittels, bindet an ein Zielmolekül (auch Target genannt), sodass es seine normale Aktivität verändert.
Heute stehen wir am Anfang der vierten Welle der Arzneimittelentwicklung, die unsere Vorstellung von der Wirkungsweise von Arzneimitteln grundlegend verändert.
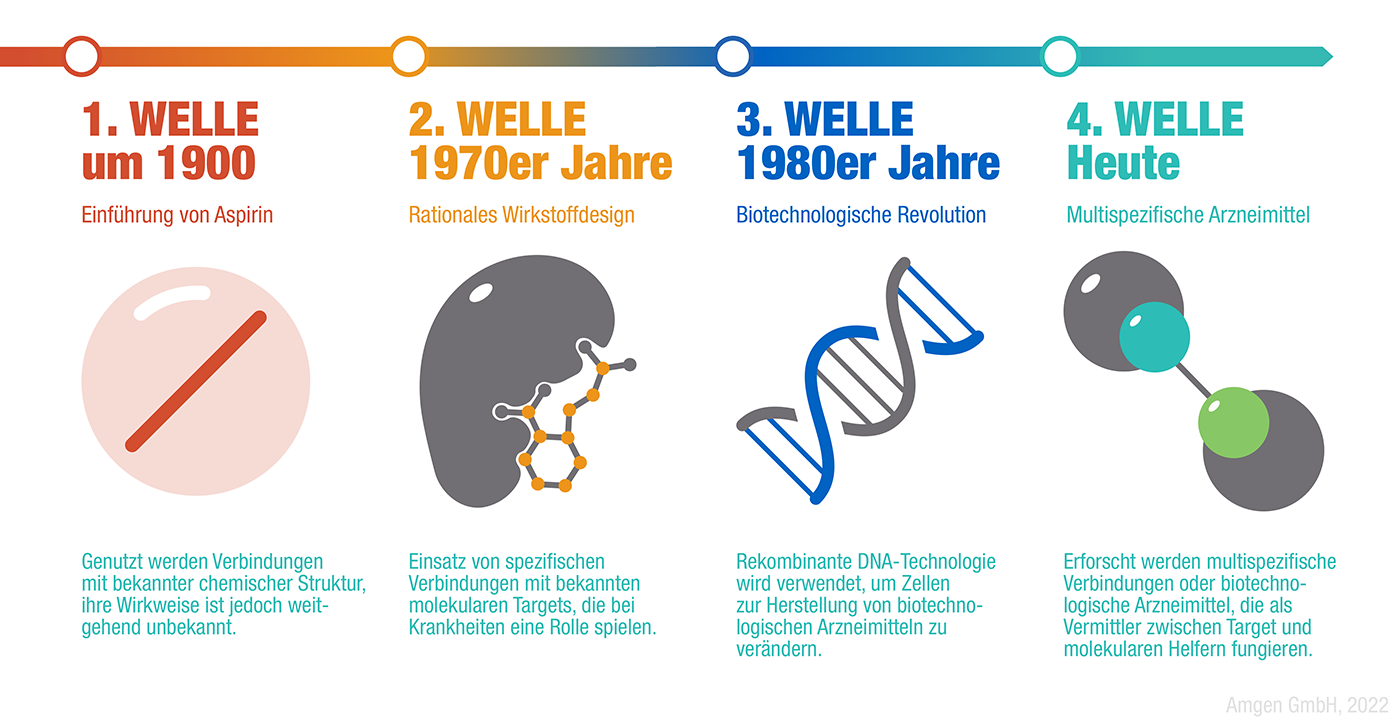
Mittlerweile werden sogenannte multispezifische Moleküle erforscht, die Verbindungen mit zwei oder mehr Proteinen eingehen können – daher die Bezeichnung „multispezifisch“. Dazu gehören auch solche Strukturen, die als molekulare Vermittler fungieren: Anstatt selbst auf das Zielmolekül einzuwirken, bringen sie das Target und solche Moleküle, die die Aktivität des Targets verändern können, in räumliche Nähe zueinander. „Die Nutzung dieses Mechanismus bedeutet eine grundlegende Veränderung in der Arzneimittelentwicklung: Bislang sind nur etwa 15 Prozent der bekannten Targets mittels herkömmlicher Wirkstoffe adressierbar. Die molekularen Vermittler ebnen nun den Weg für neue Behandlungsmöglichkeiten gegen zahlreiche Erkrankungen, die bisher als unbehandelbar galten“, erklärt Dr. Stefan Kropff, Medizinischer Direktor der Amgen GmbH.
Moleküle als Recycling-Aufkleber
Das Prinzip der induzierten Nähe lässt sich in der Natur beispielsweise beim Proteasom, dem Protein-Entsorgungssystem der Zelle, beobachten. Seine Aufgabe besteht darin, Proteine abzubauen, die nicht (mehr) gebraucht werden. Wenn eine Zelle ein unerwünschtes Protein loswerden möchte, setzt sie ein spezielles Enzym ein, die Ubiquitin-Ligase. Dieses Enzym markiert das Zielprotein mit Ubiquitin, das sozusagen als Recycling-Aufkleber fungiert. Trifft das markierte Protein nun auf ein Proteasom, wird es in dessen Inneres gezogen und in kleine Stücke zerlegt.
Dieses Konzept des molekularen Recycling-Aufklebers findet auch Anwendung in Substanzen aus einer neuen Wirkstoffklasse kleiner multispezifischer Moleküle – den sogenannten PROTAC® (Proteolysis-Targeting Chimeras). Ihre Entdeckung gibt Anlass zur Hoffnung auf neue Möglichkeiten im Bereich der Arzneimittelherstellung. Herkömmliche Medikamente wirken nur so lange, wie die Wirkstoffe an ihr Target gebunden sind. In dem Moment, in dem diese Bindung aufgelöst wird, verursacht das Target wieder die Krankheit. Ein PROTAC®-Molekül muss hingegen nicht in ständigem Kontakt mit seinem Target bleiben, da eine einzige Begegnung dessen irreversible Zerstörung auslösen kann. Ein weiterer Vorteil der PROTACs® ist darüber hinaus, dass sie nacheinander beliebig viele Targets ausschalten können.
PROTAC®-Moleküle verfügen über zwei Arme, von denen einer an das Zielprotein bindet. Der andere Arm bindet an das Ubiquitin, den molekularen Recycling-Aufkleber, der als Marker für die Zerstörung des Targets durch das Proteasom fungiert.(1) Das PROTAC®-Molekül übernimmt damit die Aufgabe der Enzyme, die das unerwünschte Protein mit dem Ubiquitin zusammenbringen. Nachdem das Proteasom die markierten Zielproteine in kleine Peptide und Aminosäuren zerlegt hat, löst das PROTAC®-Molekül seinen Arm wieder ab und greift sich das nächste Target. Da diese „catch-and-release“ Aktion beliebig oft wiederholt werden kann, wird lediglich eine kleine Menge des Arzneimittels benötigt.(2)
Ein vielversprechender Vorteil von PROTACs® ist außerdem, dass sie nicht auf eine aktive Bindungsstelle angewiesen sind (2): So wie ein Schlüssel ein passendes Schloss braucht, beschränken sich klassische Wirkstoffe auf Zielproteine mit einer Bindestelle, wie etwa Enzyme und Rezeptoren. Proteine ohne diese angreifbare Bindestelle im aktiven Zentrum gelten deshalb als „undruggable“ (nicht behandelbar) (3) – was immerhin für etwa 85 Prozent der menschlichen Proteine gilt. PROTAC®-Moleküle hingegen sind darauf nicht angewiesen, da sie mit ihren eigenen Enzymen jede beliebige Bindungsstelle nutzen können. Potenziell kann sich ihr Nutzen zukünftig also weit über die bislang behandelbaren 15 Prozent hinaus erstrecken.
Unbegrenzte Möglichkeiten für die Arzneimittelforschung
In der Biologie gibt es unzählige weitere Mechanismen, die durch induzierte Nähe funktionieren. Neben PROTAC® gibt es andere, teils noch weitgehend unerforschte, Moleküle, deren Wirkweise für die Arzneimittelforschung genutzt werden könnte. Dazu gehören AUTAC-, RIBOTAC-, LYTAC- und auch die von Amgen entwickelten BiTE® Moleküle:

Obwohl die bisherigen Erkenntnisse bereits aussichtsreich sind, stellen sie nur einen Bruchteil des Möglichen dar. Das Potenzial für neue Arzneimittel scheint endlos, begrenzt nur durch unsere technischen Möglichkeiten. Hier kann der Aufbau DNA-kodierter Wirkstoff-Bibliotheken weiterhelfen, der den Forschungsprozess bei der Suche nach geeigneten Verbindungen wesentlich verkürzen kann.
Multispezifische Moleküle stellen besonders in ihrer Entwicklung eine Herausforderung dar, doch zeichnen sich schon jetzt vielversprechende neue Verwendungsmöglichkeiten ab. Diese neue Welle der Arzneimittelentwicklung kann dazu führen, dass zukünftig mehr Krankheiten behandelt werden können, als es heute möglich ist.
Referenzen:
1. https://www.pharmazeutische-zeitung.de/proteine-in-den-abbau-zwingen/ (Zugriff: 25.04.2022)
2. https://www.pharmazeutische-zeitung.de/zweiarmige-hoffnungstraeger/ (Zugriff: 25.04.2022)
3. https://flexikon.doccheck.com/de/Proteolysis_targeting_chimera (Zugriff: 25.04.2022)
4. https://flexikon.doccheck.com/de/Lysosom (Zugriff: 25.04.2022)
5. Sourav K. Dey, Samie R. Jaffrey, RIBOTACs: Small Molecules Target RNA for Degradation, Cell Chemical Biology, Vol. 26, Issue 8 (2019): 1047-1049.



